冻干粉针剂生产时,需要在洁净的环境下将原料、辅料( 根据工艺处方要求) 和注射用水充分混合、溶解后形成中药注射用药液,之后再进行冷冻干燥、真空操作和升温处理,使得溶液变为粉末状、块状制剂,患者接受药物干预时在制剂中添加一定浓度和比例的生理盐水或葡萄糖溶液等形成混合溶液后即可注射使用,可以为那些不能口服给药的患者提供药效迅速、 作用可靠的药物治疗。因此该种用于人体注射使用的药物在生产时要按照非最终灭菌药品的无菌要求,进行生产操作。
1 制剂生产的无菌性标准
冻干粉针制剂生产期间,制药厂要按照国家2 0 1 0年修订后颁布的“药品生产质量管理规范( G MP ) ”的要求,提高车间药品生产环境的空气洁净度,在要求的洁净度环境中从事生产。首先空气洁净度要求在B 级背景下的A 级中,可以进行产品的灌装( 或灌封)、分装、 压塞; 灌装前无法除菌过滤的药液或产品的配制; 无菌原料药的粉碎、过筛、混合、分装等操作。其次在B 级环境下,可以将未完全密封处理制品、直接接触药物的包装物料等放置在密封环境中进行转运和存放的操作。最后在C、D 等级中,可以进行产品过滤、灌装前可除菌过滤的药液或产品的配制( C 级) 和直接接触药品包装物料的使用、清洁操作 ( D 级) 。
2 无菌区设计分析
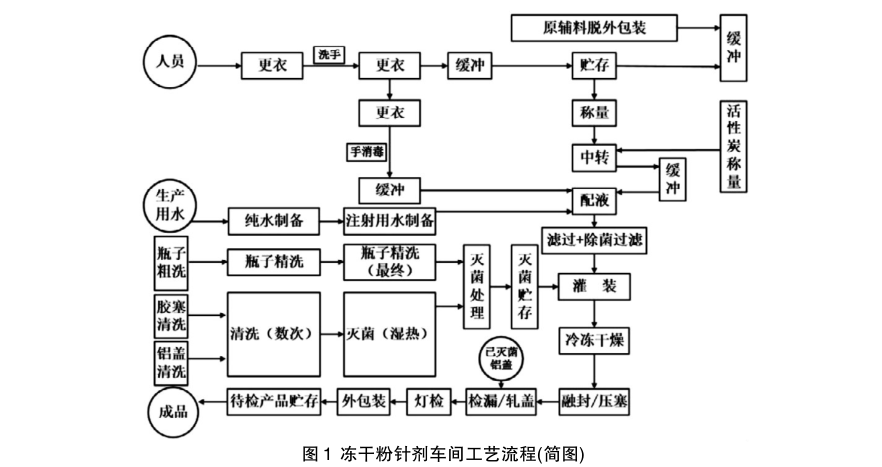
冻干粉针生产车间的环境较差或按照最终灭菌药品生产要求来生产,易导致药物制剂实际应用存在较为严重的用药安全隐患、事故。因此制药厂无菌生产车间设计人员在设计之前, 需要对冻干粉针剂工艺流程( 参见图1 ) 、生产质量管理规范的内容进行详细的调查和研究, 从无菌区域、关键工艺、无菌设备等多方面进行综合性设计。
2.1 划分区域
无菌操作要求贯穿冻干粉针生产的全过程,从空气洁净度方面进行生产区域划分时首先对于制剂使用物料的清洗,例如胶塞、西林瓶,清洗时的洁净度等级控制为D 级,经过湿热灭菌(如胶塞、铝盖等) 或干热灭菌( 如西林瓶、安瓿瓶等)处理完毕的药品物料需放置在B 级和B 级下的A级中。其次药品的灌装操作中,要求车间的空气洁净度处于B 级和A 级的等级标准下。由于设置A 级等级的车间空气环境处理系统时,花费的资金较多,现阶段的很多制药厂为了降低成本多选择B 级背景下的A 级来进行无菌生产操作。
同时进行制剂的无菌原料生产操作时可以降低空气洁净度的等级要求,在C 级的等级空气环境中进行生产操作,之后再在A 级等级空气环境中进行除菌、滤过处理。在无菌操作区域划分时,根据各项工序对于空气环境洁净度的具体要求,要在相应区域进行生产,车间生产操作人员需要按照洁净度的统一标准来进行手、衣物等的消毒、清洁。
冻干粉针生产时为了确保无菌效果最大化实现,需要做好无菌过滤工作,避免空气中的细菌等微生物进入到药液中。因此在该环节中要设置无菌控制区,包括对制剂进行无菌过滤( 除菌过滤) 、灌装和密封工序。工作人员先在人净系统区域进行作业前的净化,之后在配料区域进行制剂原料、辅料的称配操作,最后在无菌控制区进行无菌生产操作。无菌控制区的无菌过滤洁净度为C 等级,灌装或灌封区域则为A、B 等级。通过在不同操作区域设置不同等级的空气洁净度,有助于制药厂在实现成本控制基础上,有效地隔离需要保持无菌生产环境的重点区域,避免细菌等微生物的大量滋生,控制菌落数量,提高冻干粉针剂的生产质量和生产效率。
2.2 生产工艺
冻干粉针制剂生产时的主要操作环节包括: 制剂瓶和胶塞的清洗、灭菌处理,药液灌装操作和冷冻干燥操作,半加塞和全压塞,轧盖、检验、灯检、包装等操作,车间工作人员需要按照上述流程来操作设备,使得物料在每一环节的处理符合制剂质量的要求,避免物料使用性能下降。具体生产时,工作人员需要将有相同空气洁净度要求的工序,放在同一个操作环境中进行作业,工艺布局尽量合理、规范,避免划分多个操作区域造成车间区域面积的浪费问题。例如可以将洗瓶、洗塞等生产工序的操作房间放置在同一个区域内,设置专门的人员净化系统来对车间环境、工作人员进行净化处理。同时由 于无菌过滤、灌装等工序的空气洁净度要求基本一致,与洗瓶等工序的洁净度要求差异较大,因此处于该区域的人员净化系统需重新设置,便于工作人员可以按照系统程序的要求,进行脱衣、消毒、穿着无菌衣物、再次洗手消毒操作处理,之后再进入无菌生产区域进行生产。员工穿着的工作服、无菌鞋要求在C 、D 两个等级的洁净度空气环境中进行清洗、消毒,之后在无菌区进行灭菌后才可以穿着应用 在生产中。此外工艺布局中托盘流转也是重要的生产工序。 生产时需要将药物生产材料、辅料放置在托盘上,每个环节操作后送到其它的操作设备上进行生产操作,处于无菌区域的生产设备全部要使用冻干使用的专用托盘,无菌区之后根据设备运转的机组确定使用的托盘类型,如果车间使用的是洗烘瓶联动机组,无菌区不能出现排瓶用托盘。使用完毕后,在无菌区域对所有托盘进行清洁和消毒,保证所有托盘的干净整洁;如果洗瓶使用设备为单独设备,生产使用的托盘可以再次利用,工作人员要及时将其运送到无菌区进行利用。
2.3 设备使用
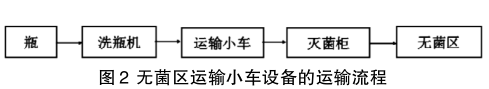
国家颁布的G M P可以有效规范药品生产时的环境质量,保证流入市场的所有药物均有着良好的药用价值和效果,因此制药厂要积极学习规范中对于不同空气洁净度下操作行为的规定, 并进行掌握,以便在相应的区域做好无菌化的操作。药品生产中的设备与药物会直接接触, 如果设备上留有较多的菌落,会造成药品的全部污染,因此无菌区的药品制备设备的无菌化使用也需要制药厂进行重点关注,使用前后应用有效手段进行充分的清洗,杜绝清洗后发生设备的二次感染。冻干粉针生产时使用的胶塞、瓶在送至无菌区使用之前,要提前做好灭菌处理工作,待到符合无菌生产要求后,即可进行药物的灌装、压塞等的设备生产操作。由于制药时的精洗工序操作时空气洁净度为D 级,空气中每立方米允许悬浮的粒子数量、浮游菌、沉降菌、设备和手套可以接触到的表面微生物较多,如果将瓶、胶塞的处理工序放置在该等级环境中进行,将有着极高的风险发生设备的二次污染问题,之后在应用中导致药物的生产感染问题。因此需要对使用 的胶塞清洗灭菌设备、洗烘瓶联动设备进行设备的灭菌清洗操作,最大化的减少二次污染问题的发生率。但是这两项设备结构复杂、构造精密,对于员工的操作要求较高,且维修养护价格昂贵,部分制药厂全部采买的经济负担较大,导致在目前的制药生产中未全面普及。但是企业为了保证药品的生产质量和使用安全,可以采购其中的一项设备,对车间生产的灭菌清洗工作进行工作效率和质量的提高。此外在这两种设备使用时,可以在无菌车间设置一个运输小车(参见图2),并且要使用 空气洁净技术对小车进行表面微生物、细菌净化处理,具备A 级层流装置,减少与其他设备接触时发生的污染问题。还要对两种设备入口位置进行空气洁净处理,使得胶塞、瓶清洁处理、运送到无菌区时有着A 级层流的良好保护,有效杜绝设备二次污染对药品生产质量造成的诸多影响。对运输胶塞、瓶的小车进行设计时,为了避免供电线路携带病菌对设备造成污染风险,可以在小车上设置风机、电瓶,进行直流电的运行供电。
3 结语
冻干粉针制剂厂在进行制剂生产时,考虑其工艺特点为非最终灭菌工艺,因此在最初进行工艺路线设计时应当充分考虑到无菌生产工艺操作的流程顺序、各工序洁净度等级要求、人员 及物料进入操作区域路线等问题,充分评估其路线的合理性、经济性,为后期生产提供切实有效的工艺环境。另需重视药物本身对于无菌性生产操作环境的要求,科学合理的划分制剂无菌生产车间区域,减少外界环境、人为等因 素导致的制剂污染问题。
- 上一篇:千级净化车间热负荷平衡方案
- 下一篇:医药洁净厂房净化工程管理











